近日,国内IVD领域迎来一项重要突破——北京中科生仪科技有限公司研发的“全自动医用PCR分析仪(P1000F Dx)”正式获得国家药品监督管理局三类医疗器械注册证(国械注准20253222731)。这标志着我国首款手持式、全自动核酸快检一体机正式获批上市,有望为现场化、快速化分子诊断带来革命性变化。

一款“可以拿着走的PCR实验室”
该设备重量仅约1公斤,外形如POS机大小,真正实现了“手持携行”。它基于磁珠法核酸提取与实时荧光PCR技术,将样本裂解、核酸提取、纯化、扩增、检测及数据分析全流程集成于一体,可在约30分钟内完成检测,并支持RNA与DNA靶标。
设备内置可充电电池,可持续运行约3.5小时,无需外接电源与辅助设备。试剂采用常温运输保存技术,配合专属预装型芯片,使用时只需加入样本、装载芯片,即可启动全自动检测,极大降低了操作门槛与人员依赖。
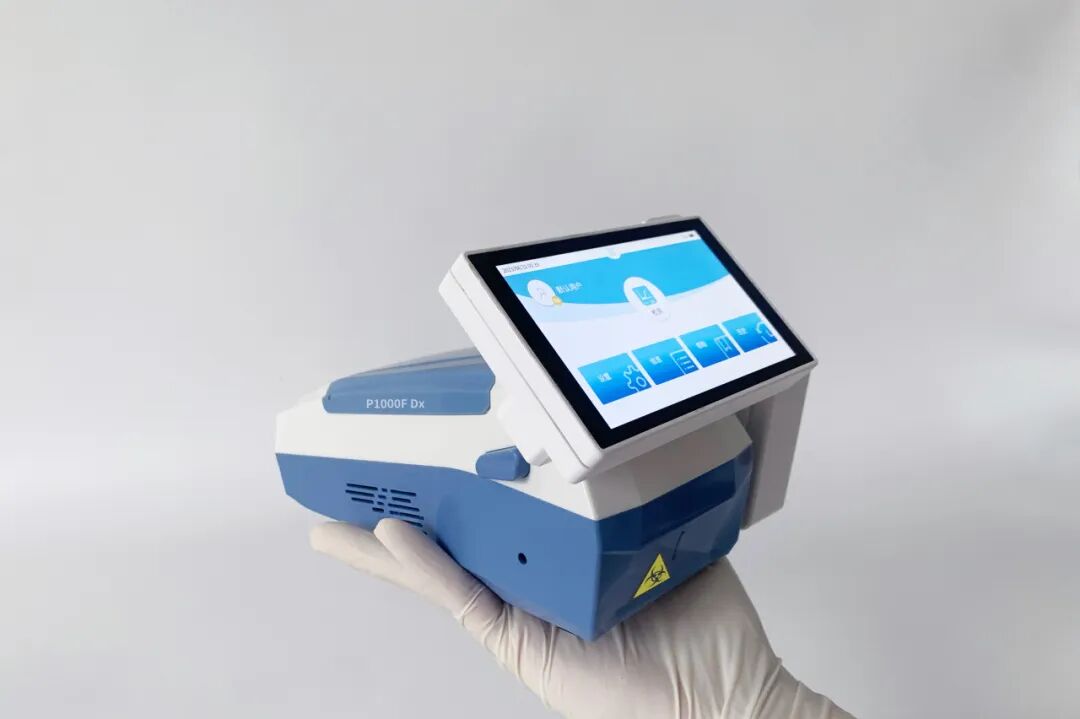
从概念到获批,十余年自主研发路
实际上,这款设备的故事始于2009年。中科生仪团队最初立项时,便瞄准了一体化、小型化核酸快检设备的方向。然而,受限于当时国内产业链配套能力,项目进展缓慢。
随着我国工业制造与光学、材料、微流控等关键技术的整体提升,团队逐步攻克了在极小体积内实现超声裂解、磁珠提取、快速温控、多荧光通道检测等一系列难题。2020年,其原型机“CarryOn P1000Q”首次亮相时,便因“40分钟出结果、五色荧光、无线传输”等特性引发行业关注。
如今,正式获批的P1000F Dx不仅在检测速度上进一步提升至30分钟,更在系统可靠性、数据智能判读、远程传输(支持4G/WiFi/蓝牙)等方面实现优化,并兼容医院信息系统(HIS/LIS),适合门急诊、基层医疗机构、海关、机场等多样场景。
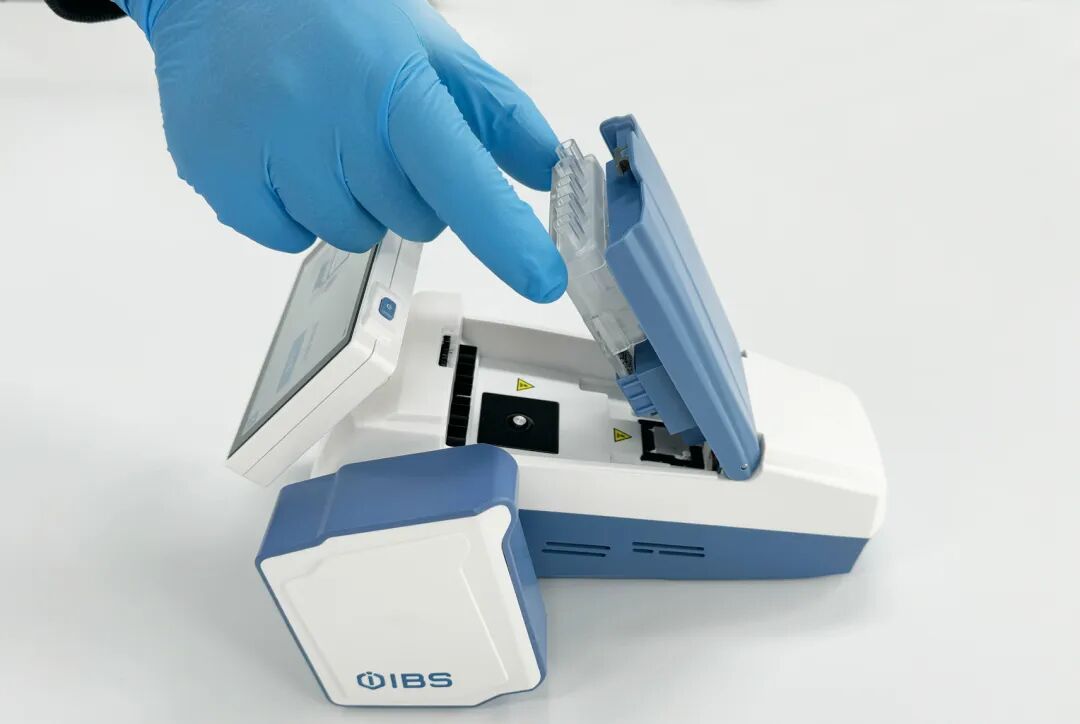
为何是“重磅”?
三类医疗器械注册证是国家对高风险医疗器械安全有效性的最高级别认可。此次获批,不仅是对产品本身技术实力的背书,也意味着该设备已具备进入临床应用的完整资质。
在当前深化分级诊疗、强化传染病防控的背景下,这种无需专业PCR实验室、可随时随地进行精准核酸检测的设备,有望大幅提升基层与现场检测能力,为疫情防控、急诊诊断、边境检疫等提供高效工具。
未来展望:从“单兵作战”到“系统集成”
据了解,中科生仪团队已在布局下一代产品研发,方向包括增加单次检测靶标数量,以及开发模块化、高通量系统,实现“积木式”灵活扩展。公司目前已拥有数十项国内外专利,并获评北京市“专精特新”中小企业等多项资质。
这款手持PCR仪的上市,不仅是一款产品的成功,更是中国在高端分子诊断装备领域自主创新与产业链整合能力的一次重要展示。它预示着,在精准医疗与现场化检测的时代,国产设备正快步走向舞台中央。
新闻来源:结合北京中科生仪科技有限公司官方公告(2026年1月5日)及相关行业历史报道整理。
声明:本微信注明来源的稿件均为转载,仅用于分享,不代表平台立场,如涉及版权等问题,请尽快联系我们,我们第一时间更正。